Terremotos

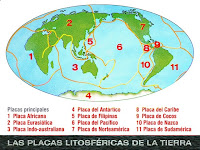
TERREMOTOS Causas de los Terremotos Los terremotos ocurren cuando la tensión producida por el movimiento de las placas hace que la roca se rompa debajo de la superficie y dicha tensión se libera de repente. A medida que se rompe la roca las ondas sísmicas viajan hacia el exterior. Estas ondas sísmicas pueden detectarse por sismógrafos y, utilizados con relojes extremadamente precisos, los científicos pueden indicar con precisión el foco del terremoto (el punto en el que la roca se rompe y por lo tanto el centro de la propagación de las ondas). El punto en la superficie de la Tierra que está justo encima del foco se llama el epicentro. Distintos tipos de ondas sísmicas son liberados durante un terremoto: .*Primarias u ondas P ( ondas de presión) son las más rápidas y las que primero se notan, sacudiendo la tierra hacia adelante y hacia atrás. .*Secundarias u ondas S ( llamadas ondas cortantes) son más fuertes, lentas y viajan a través de la corteza con un movimiento de arriba a abajo....